Hiermit bestätige ich, dass ich einen medizinischen oder pharmazeutischen Beruf ausübe [Ärzt*in, Apotheker*in, Pharmazeutisch-technische*r Assistent*in (PTA), Medizinische*r Fachangestellte*r (MFA)].
Bronchiektasen
Pneumologie
Steckbrief
Bronchiektasen sind irreversible Aufweitungen der Atemwege, meist verursacht durch eine chronische, eitrige Entzündung. Mikrobielle Infektionen oder Fehlbesiedelungen haben meist eine zentrale Rolle in der Pathogenese. Bronchiektasen bei Mukoviszidose (CF-Bronchiektasen) werden von anderen Formen, non-CF-Bronchiektasen, unterschieden. Letztere haben vielfältige angeborene oder erworbene Ursachen. Die wesentliche Symptomatik besteht aus Husten, oft großvolumigem Auswurf und Hämoptysen. Akute Exazerbationen beeinflussen den Erkrankungsverlauf stark. In der Diagnostik hat das CT eine wichtige Rolle, weiterhin wurde versucht, die Ursache der Erkrankung zu finden. Pathogene Keime in der Lunge müssen identifiziert werden. Die Behandlung besteht in der Therapie der Grunderkrankung, Physiotherapie und antimikrobieller Behandlung.
Synonyme
- non-CF-Bronchiektase
Keywords
- Bronchiaktasen, non-CF-Bronchiektasen
Definition
-
Bronchiektasen sind irreversible Erweiterungen oder Ektasien der Bronchien und werden nach ihren Erscheinungsformen in zylindrische, variköse und zystische Bronchiektasen eingeteilt.
-
Sie führen zu einer chronisch putriden Bronchitis mit Destruktion der peripheren Atemwege, die interkurrierend exazerbieren kann.
Epidemiologie
Häufigkeit
- Inzidenz: 20–40 pro 100000 Personen
- Prävalenz: 130–15 pro 100000 Personen
- Die Häufigkeit von Bronchiekstasen nimmt zu, wohl assoziiert mit Infektionen mit nicht tuberkulösen Mykobakterien (NTM).
- Die verbesserte Bildgebung führt zu einer besseren Erkennung.
Altersgipfel
- Zunahme mit steigendem Alter
Geschlechtsverteilung
- häufiger bei Frauen (ca. 1:2)
Prädisponierende Faktoren
- Eine Vielzahl von erworbenen oder angeborenen Zuständen kann zu Bronchiektasien führen.
Ätiologie und Pathogenese
- Zug, Druck und Schwächung an den Wänden der Atemwegen führt zu Ektasie oder Aufweitung.
- Die geht parallel mit einer chronischen Infektion, neutrophilen Entzündung und Gewebedestruktion.
- Erworbene Ursachen: Wesentlich häufiger als angeborene. Im Vordergrund stehen schwere oder chronische Bronchialerkrankungen mit Superinfektion oder schwere lokale Infektionen mit Erliegen des Zilientransportes (s. Tab. 75.1).
- Angeborene Ursachen: Anatomische, funktionelle und immunologische Störungen (werden durch rezidivierende Infektionen wirksam (s. Tab. 75.1)
| Merke Bei einem großen Teil der Bronchiektasen lässt sich keine Ursache identifizieren! Jedoch sollte stets eine Basisdiagnostik durchgeführt werden, um die Ursachen der Bronchiektasien zu identifizieren. |
|
|
|
|
|
|
|
|
Pathogenese
- Intensive, meist mikrobielle Entzündung der gesamten Bronchialwand mit Peribronchitis zusammen mit einer mukoziliären Transportstörung.
- Die neutrophile, eitrige Entzündung führt zu einer Destruktion der Bronchialwand mit narbigem Umbau und durch zentrifugalen Narbenzug zu irregulärer Dilatation.
- Folge ist eine weitere Verschlechterung des Sekrettransportes sowie eine entzündlich induzierte Hyper- und Dyskrinie mit Sekretretention.
- Es entsteht ein Teufelskreis aus Infektion bzw. Fehlbesiedelung, chronischer Entzündung, Gewebedestruktion und Schwächung der Abwehr.
- Bronchiektasen beruhen auf einer Dilatation und Destruktion der bronchialen Wände, was die Struktur und Funktion der luftleitenden Atemwege permanent verändert.
- Infizierter Mukus sammelt sich in Bronchiektasen an und die Atemwege sind chronisch entzündet.
- Das hat eine Hyperplasie und Hypertrophie der mukusproduzierenden Drüsenzellen und eine squamöse Metaplasie zur Folge.
Klassifikation und Risikostratifizierung
- Lokalisation:
- bilateral in den Unterlappen (am häufigsten)
- fokal durch Fremdkörper, Tumorstenose, stenosierende Lymphknoten oder Sekretverlegung (selten)
- diffus (30%) nach Aspiration von Flüssigkeiten, Inhalationstrauma, diffuser Infektion
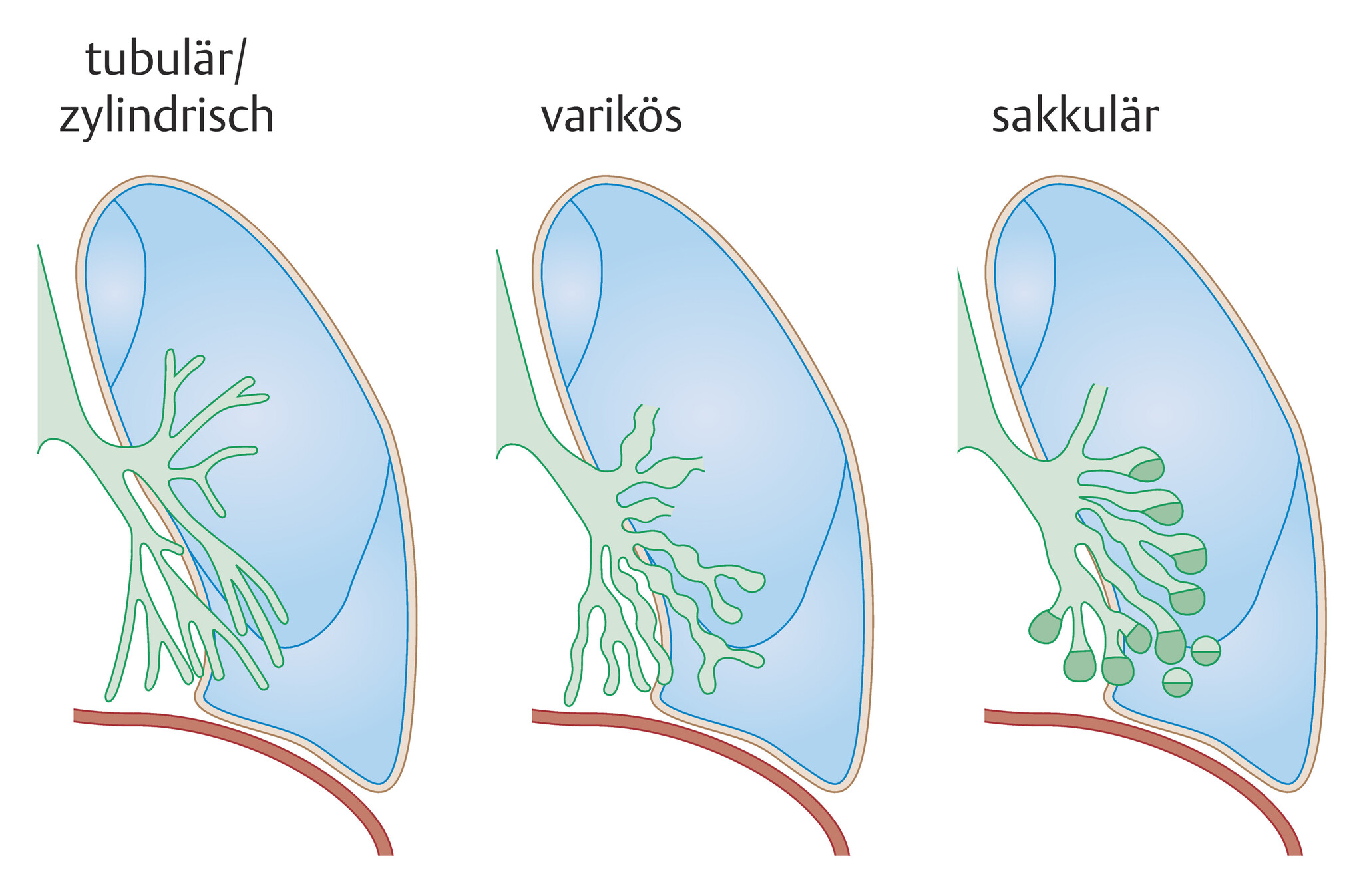
- Form (Abb. 75.1):
- zylindrische (tubuläre) Bronchiektasen: treten häufig vor dem Erwachsenenalter auf und sind oft beidseitig und im dorsobasalen Unterlappen lokalisiert (meist in den Bronchien der 6.-8. Teilungsgeneration)
- sackförmige (zystische) Bronchiektasen: auch in den Mittel- und Oberfeldern (dann auch als „trockene“ Bronchiektasen), sie enden in abszessartigen Hohlräumen mit Distanz zur Pleura (im Gegensatz zu Abszessen); im Gegensatz zu zylindrischen Bronchiektasen sind sie häufiger diffus verteilt und weiter zentral lokalisiert
- bei fokalen, isolierten Bronchiektasen normale Lungenfunktion
- die Funktionseinschränkung wird von der Grunderkrankung mitbestimmt, meist ist eine kombinierte restriktive und obstruktive Ventilationsstörung nachweisbar
- eine (meist mild ausgeprägte) Hypoxämie kommt durch Anastomosen (Links-Rechts-Shunt) zwischen Bronchial- und Pulmonalarterien zustande
- Einteilung nach der Menge des produzierten Sputums (feucht vs. trocken) wird kaum noch verwendet
- typischer Phänotyp ist der „frequent exacerbator“ mit häufigen Exazerbationen, schlechter Lebensqualität und schlechter Prognose
Abb. 75.1 Einteilung der Bronchiektasen nach Reid.
(Quelle: nach Kroegel C. Bronchiektasen. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. doi:10.1055/b-002-57146)
| Merke Akute Exazerbationen sind typische Ereignisse, die mit einer vermehrten Entzündung und Infektion assoziiert sind. Exazerbationen beeinflussen die Lebensqualität und die Prognose. |
- Durch eine Störung der Abwehr kommt es zur chronischen Besiedelung bzw. Infektion mit typischen Mikroorganismen:
- Haemophilus influenzae,
- Pseudomonas aeruginosa,
- Moraxella catarrhalis,
- Streptococcus pneumoniae
- und Staphylococcus aureus.
- Auch NTM, Aspergillus, Stenotrophomonas oder Acinetobacter können gelegentlich identifiziert werden und sind oft mit typischen Verläufen assoziiert. Typischerweise ist eine Besiedelung mit Pseudomonas erst im späteren Krankheitsverlauf zu finden.
| Merke Bei bis zu 20% der Sputumproben von Patienten mit Bronchiektasen lässt sich kein Pathogen kultivieren! Mikrobiologische Untersuchungen sind wichtig, um die antibiotische Therapie zu steuern. |
| Hintergrundwissen Pierre-Marie-Bamberger-Syndrom Das seltene Marie-Bamberger-Syndrom (hypertrophe Osteoarthropathie) ist nach den Erstbeschreibern, dem französischen Neurologen Pièrre Marie (1853–1940, Paris) und dem deutschen Arzt Eugen von Bamberger (1858–1921) benannt. Bamberger beschrieb die Krankheit 1889 erstmals und stellte den Zusammenhang zu chronischen Herz- und Lungenkrankheiten her. Marie differenzierte die Erkrankung 1890 von der Akromegalie. Sie tritt als Folge von chronischen Lungen- und Herzerkrankungen (zystische Fibrose, Bronchiektasen, Tuberkulose, Lungenfibrose, Herzvitien, seltener Leberzirrhose oder Colitis ulcerosa) auf und führt zu Veränderungen an den Knochen und den Extremitäten. Dabei kommt es zu schmerzhaften Auftreibungen, vor allem im Bereich der Diaphysen der langen Röhrenknochen oder der langen Röhrenknochen der Extremitäten mit trommelschlägelartiger Verbreiterung der Finger und Zehen (sog. Trommelschlägelfinger bzw. ‑zehen) sowie Uhrglasnägeln. Die ossären Veränderungen mit breitflächigen knöchernen Verdickungen im Bereich der Knochenhaut beruhen auf der Überproduktion von Wachstumshormonen. Eine Ursache des Marie-Bamberger-Syndroms können Tumoren (z.B. Bronchialkarzinom) sein. Diese müssen bei nicht erkennbarer Ursache ausgeschossen werden. |
Symptomatik
- Chronischer, produktiver, zum Teil quälender Husten, vor allem am Morgen. Vereinzelt auch überwiegend trockener Husten.
- Voluminöses Sputum (klassisch: Dreischichtung mit eitrigem Bodensatz, seröser Mittelschicht und schaumiger Oberschicht, selten zu finden).
- Im Verlauf zunehmende Dyspnoe.
- Häufige Exazerbationen mit vermehrt eitrigem Sputum, Luftnot und Fieber.
- Uhrglasnägel und Trommelschlägelfinger (bei etwa 30 % der Patienten)
- Hämoptysen oder Blutbeimengungen im Sputum (vor allem im Erwachsenenalter)
- Gewichtsverlust, Anämie und gelegentlich Fieber.
- Mittelblasige bis grobblasige Nebengeräusche.
| Merke Bei Patienten mit diffusen Bronchiektasen wird häufig gleichzeitig eine Sinusitis beobachtet. Die Ursache hierfür ist abgesehen von der Ziliendysfunktion nicht bekannt. Unabhängig davon dürfte die chronisch rezidivierende Sinusitis für die Exazerbation und die anhaltende Infektion mit verantwortlich sein. |
- Bei akuten Exazerbationen nehmen Husten und Auswurf zu, es kann sich ein infektiöses, zum Teil septisches Krankheitsbild zeigen.
Diagnostik
Diagnostisches Vorgehen
Die Diagnostik bei Bronchiektasen beinhaltet verschiedene Aspekte:
- Diagnose der Erkrankung durch die Bildgebung (Hinweise im Röntgen, Beweis im CT).
- Differenzialdiagnose der Ursache, hier sind zahlreiche seltene Krankheiten mit einzubeziehen (Schweißtest, Immunglobuline, AAT, nasales NO, Autoantikörper, ABPA).
- Identifikation der mikrobiellen Infektion/Fehlbesiedelung, gerade bei der akuten Exazerbation.
- Beurteilung der funktionellen Einschränkung (Lungenfunktion, Blutgase, Spiroergometrie, 6-Minuten-Gehstrecke).
- Die Basisdiagnostik besteht in Anamnese, Untersuchung, Lungenfunktion, BGA, HRCT, Sputummikrobiologie.
Anamnese
- Positive Familienanamnese, rezidivierende Sinusitiden als Hinweis auf kongenitale Faktoren.
- ggf. schwere respiratorische Infektion in der Kindheit oder rezidivierende Pneumonien.
- Chronisch anhaltender produktiver Husten mit Expektorationen eines voluminösen purulenten Sputums (>2 Esslöffel pro Tag).
- Der Verdacht auf Bronchiektasen ergibt sich aus dem meist morgendlich produzierten mundvollen und süßlich-faden bis übel riechenden Auswurf.
- Nach längerem Stehen bilden sich 3 Schichten, bestehend aus Schaum (oben), lipidhaltiger Mukus (Mitte) und Pus (unten).
- Die ist typisch, tritt aber keineswegs bei allen Patienten auf.
Körperliche Untersuchung
- Allgemein: Häufig subfebrile Temperaturen, als Nebenbefund oft nasale Polypen.
- Inspektion: Bei voller Ausprägung Zyanose, Trommelschlegelfinger.
- Auskultation: Leises Atemgeräusch früh- bis mittelinspiratorische Rasselgeräusche, mittel- bis grobblasig. Häufig exspiratorisches Giemen und Brummen wie bei chronischer Bronchitis.
- Perkussion: Lokalisierte Klopfschalldämpfung über betroffenen Arealen.
- Hinweise auf ursächliche Erkrankungen: Schluckstörungen mit Aspirationen bei HNO oder neurologischen Erkrankungen.
Labor
- Blutbild und Differenzialblutbild
- Diagnostik auf Mukoviszidose (Schweißtest, ggf. Genetik).
- Diagnostik auf α1-Antitrpsinmangel (AAT Serumspiegel, Genetik).
- Gesamt-IgE, IgG – Präzipitine
- HIV-Test
- Konzentration der Serumimmunglobuline (IhM, IgA, IgG sowie IgG-Subklassen
- IgG1, IgG2, IgG3 sowie IgG4), Antikörper-Antwort auf Vakzin-Antigene (z.B. gegen PPV23 Pneumokokken-Vakzin)
- Nachweis einer Sensibilisierung gegen Aspergillus (ABPA, Prick-Hauttest, spezifische IgG, erhöhte Eosinophile, Gesamt-IgE >1000IE/ml)
- Chronische entzündliche Erkrankungen: rheumatoide Arthritis (RF, -Antikörper), SLE, ankylosierende Spondylitis, Entzündliche Darmerkrankungen, Vaskulitiden (ANA, ANCA)
Mikrobiologie
- Mikrobiologische Untersuchungen aus Sputum, induzierten Sputum oder eine bronchoskopischen Materialgewinnung.
- Neben pathogenen Keimen sollte auch auf Pilze (ggf. Aspergillus-Antigen), Viren, und Mykobakterien untersucht werden.
Bildgebende Diagnostik
Röntgen
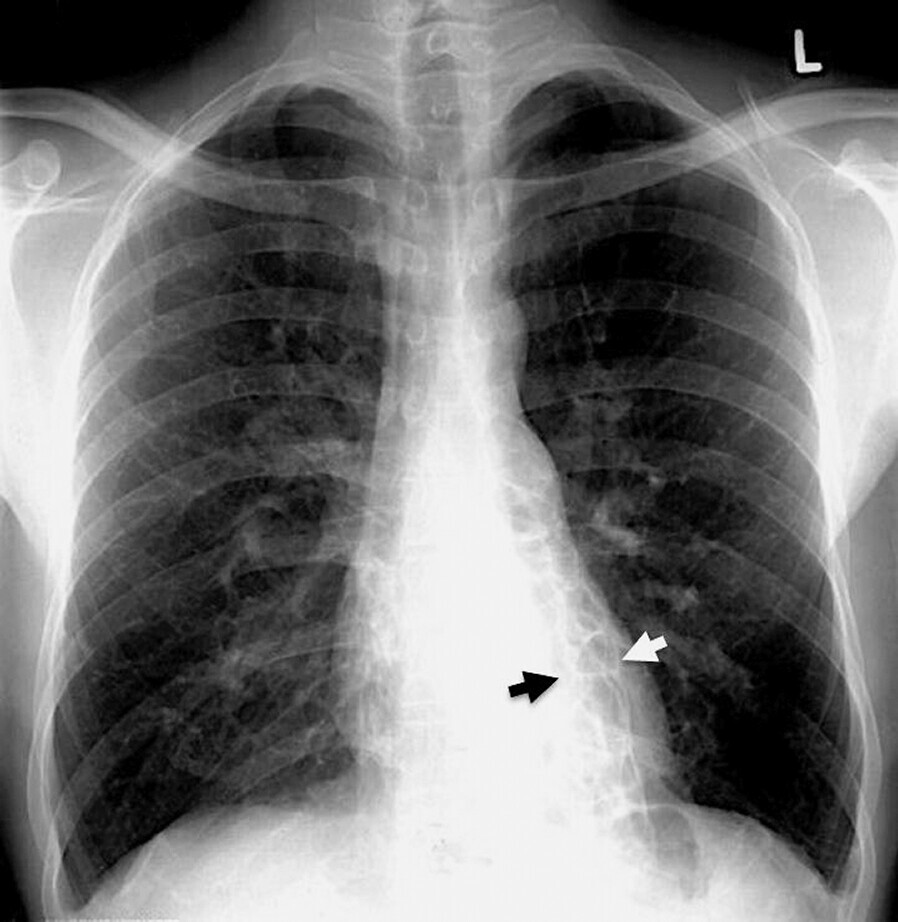
Im konventionellen Röntgenbild finden sich Hinweise auf Bronchiektasen (Abb. 75.2), (Tab. 75.2):
- verdichtete, verdickte Bronchialwände, Bild der „dirty chest“
- Narbenzüge, vereinzelte Dystelektasen
- parallele Streifenzeichnung („Straßenbahngleise“)
- zystische Hohlräume, z.T. mit Spiegelbildung
- lokalisierte Pleuraverdickung
- Infiltrate mit eingeschlossenen Hohlräumen
- in 5–10% der Fälle normales Röntgenbild
Abb. 75.2 Bronchiektasen im Röntgen-Thorax.
32-jähriger Mann mit kongenitalen sakkulären Bronchiektasen in beiden 10er-Segmenten. Die verbreiterten Bronchialsäcke und verdickten Bronchialwände lassen sich durch den Herzschatten als „netzwerkähnliche“ Strukturen erkennen (links > rechts, Pfeile). Nebenbefundlich sind die kostodiaphragmalen Winkel aufgrund rezidivierender Infektionen mit Begleitpleuritis verplumpt.
(Quelle: Kroegel C. Bronchiektasen. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
|
Röntgen-Thorax |
|
|
|
CT
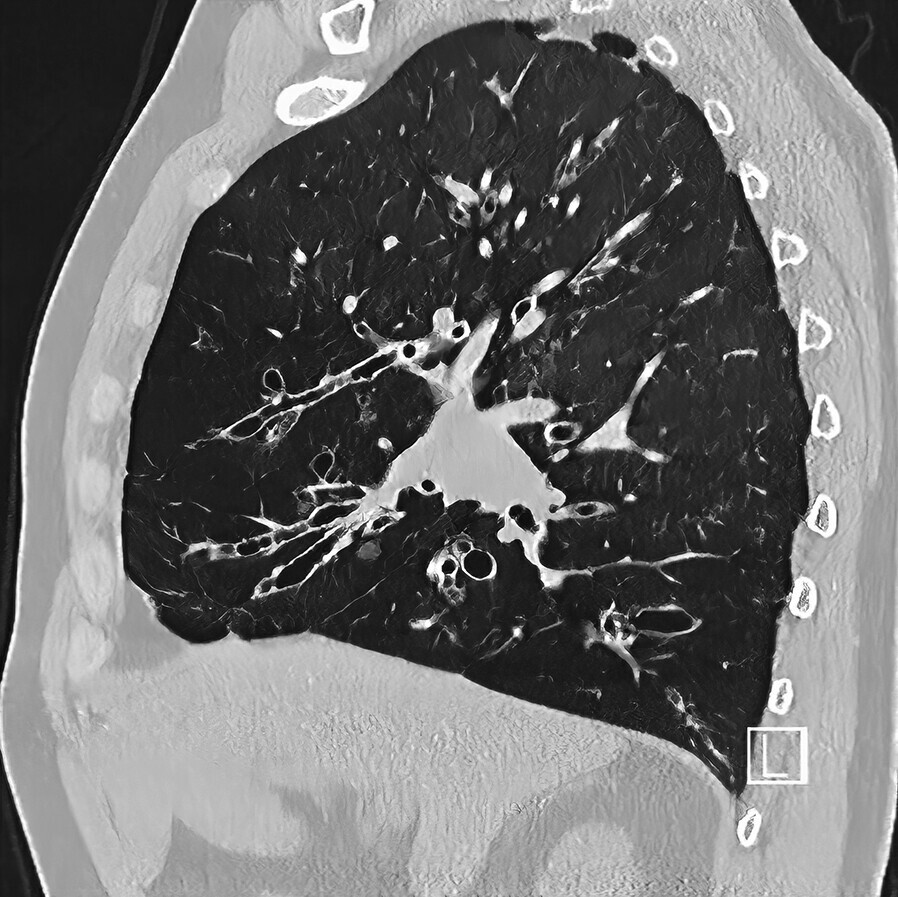
- Diagnose wird im CT gestellt, hierzu ist ein HRCT wichtig (Abb. 75.3)
- Typischer Befund: irreguläre bis monströse Bronchuserweiterung im Bereich der 6.-8. (zylindrische) oder 5.-7. (sakkuläre) Bronchusgeneration, verdickte Bronchuswand, peribronchiale Infiltration, Flüssigkeitsfüllung in den Mittel- und Unterfeldern.
- Tram-Track-Zeichen: longitudinaler Anschnitt eines verbreiterten Atemwegs ohne Verschmälerung.
- Atemwege zeigen einen größeren Durchmesser als die begleitende Arterie (Siegelringzeichen).
- Wertung: direkte Darstellung mit topografischer Zuordnung, gleichzeitige Darstellung der Folgezustände (Parenchymdestruktion, Aspergillom).
- Die Verteilung der Veränderungen im CT ergibt Hinweise auf die Ätiologie: Oberfeld, CF, TBC, Silikose, Sarkoidose; Mittelfeld, PCD, Aspirationen, Mittellappen-Syndrom, NTM; Unterfeld, PCD, Aspirationen, CTD, AATD.
- Füllung mit Schleim (Mucus plugging).
- Die Inspirationslage bei der Durchführung des CT beeinflusst die Darstellung, insbesondere die Weite der Atemwege.
Abb. 75.3 Bronchiektasen in der hochaufgelösten CT-Aufnahme (HRCT).
(Quelle: Klinik für Diagnostische und Interventionelle Radiologie, UKS)
Instrumentelle Diagnostik
Lungenfunktion
- In >50% findet sich eine Obstruktion.
- Meist restriktiv-obstruktives Mischmuster.
- Die BGA dient zur Einschätzung einer möglichen respiratorischen Insuffizienz.
- Nasales Stickstoffmonoxid (nNO) wird gemessen, um eine primäre Ziliendyskinesie zu identifizieren.
- Dieses ist hierbei stark erniedrigt (<77nL/min).
- Danach erfolgt eine genetische Testung.
Bronchoskopie
- Eine Bronchoskopie gehört fakultativ zur erweiterten Diagnostik, insbesondere bei unklaren Fällen, auch zur invasiven Erregeridentifizierung.
- Darstellung von Bronchusstenosen.
- Nachweis einer diffusen chronisch-deformierenden Bronchitis.
- Invasive Erregerdiagnostik.
BAL
- Erregerdiagnostik
- Neutrophiles Zellbild
Sonstiges
Merke Sputumdiagnostik erfolgt bei ausgeprägtem Befund regelmäßig wie bei Mukoviszidose. |
- makroskopisch: Volumen, Dreischichtung
- mikroskopisch: massenhaft neutrophile Granulozyten, Zelldetritus
- Kultur: Nachweis von S. pneumoniae, H. influenzae und Moraxella catarrhalis, später zunehmend gramnegative Enterobakterien, bei fortgeschrittenem Leiden auch Pseudomonas species
Differenzialdiagnosen
- zystische Lungendegeneration: im CT fehlender Bronchusanschluss, glatte Wandung
- isolierte Lungenzysten: im CT fehlender Bronchusanschluss, glatte Wandung, dünne Wand, in der Umgebung normales Parenchym.
- Lungensequester (s. Hintergrundwissen)
- chronisch obstruktive Bronchitis mit Bronchusdeformation mit fließenden Übergängen in Bronchiektasenbildung.
Hintergrundwissen Pulmonale Missbildung mit Separation (Sequestration) eines dystopen, funktionslosen Lungenanteils von der Hauptlunge. Das dysplastische Gewebe enthält Zysten und unbelüftete bronchiale und alveoläre Strukturen. Manifestationsformen Extralobär (ca. 10–15% aller Fälle): komplette Trennung von der Hauptlunge, besitzt eigene Pleura visceralis (Nebenlunge), häufig links zwerchfellnah lokalisiert. Arterielle Versorgung aus einem aortalen Ast und Abfluss in das Venensystem des großen Kreislaufs. Meist keine Beschwerden und damit Zufallsbefund, wegen der kompletten anatomischen Trennung nur selten Infektionen. Intralobär: stets innerhalb eines Lungenlappens gelegen, ohne eigene Pleura visceralis, meist im dorsobasalen Unterlappensegment lokalisiert. Verbindungen an angrenzende Atemwege der normalen Lunge möglich, was Entstehung von Infektionen begünstigt. Arterielle Versorgung durch Aortenäste und Abfluss in die Pulmonalvenen. Symptomatisch bei Komplikationen wie Pneumonie, Abszess und Bronchiektasen. Diese stellen eine Operationsindikation dar. |
Therapie
Therapeutisches Vorgehen
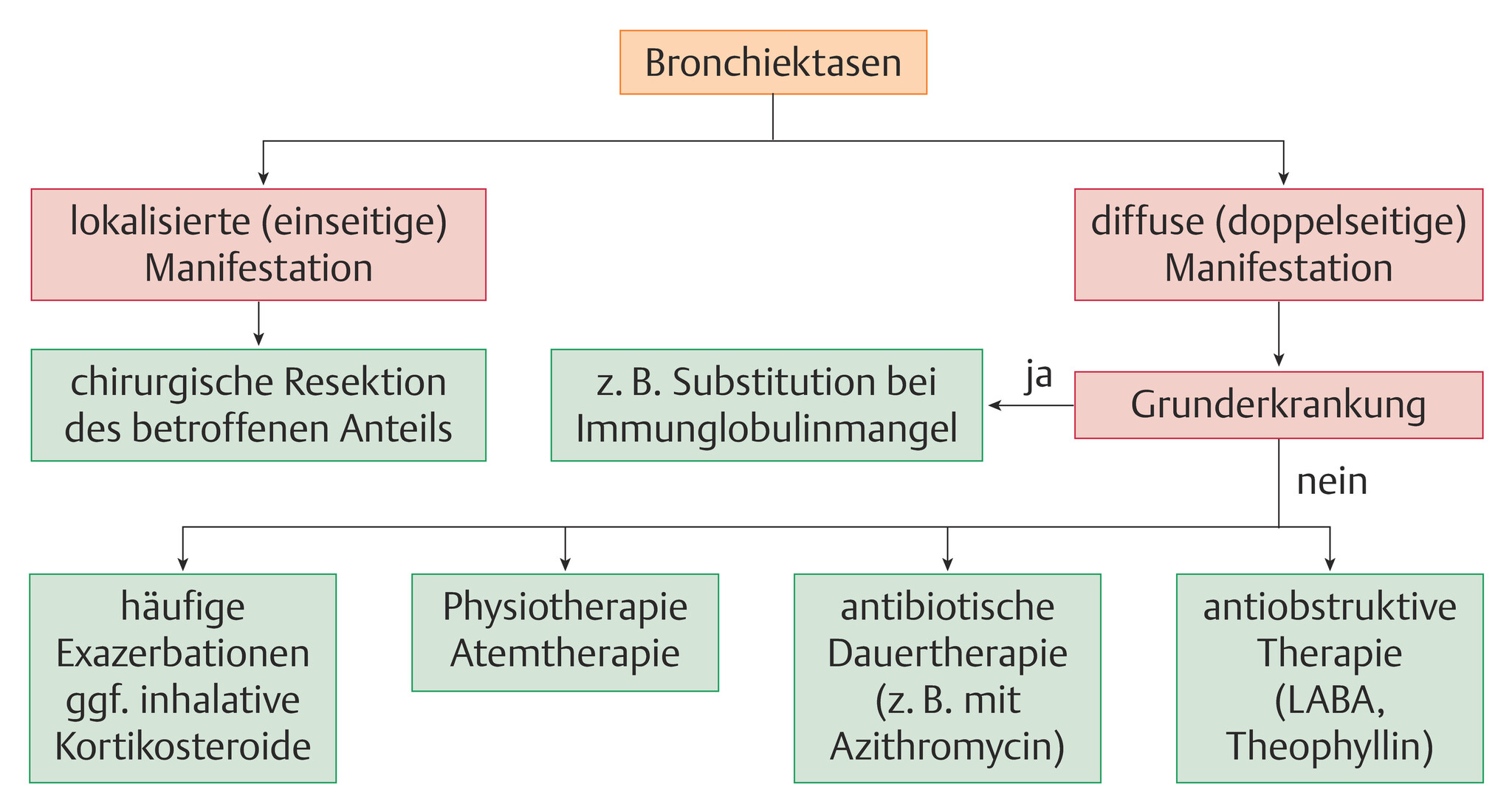
- Die Behandlungsprinzipien bestehen in:
- der Behandlung der Grunderkrankung, sofern diese gefunden werden kann; z.B. Substitution von Immunglobulinen bei Ig-Mangel
- der antimikrobiellen Therapie, im chronischen Verlauf nach Antibiogramm (oral, intravenös, oder inhalativ)
- der Sekretmobilisation, Atemwegshygiene
- der Physiotherapie
- in seltenen Fällen der chirurgischen Resektion oder der Lungentransplantation (s.a. Abb. 75.4).
Abb. 75.4 Algorithmus der Bronchiektasentherapie.
LABA: lang wirksame β2-Mimetika.
(Quelle: Kroegel C. Bronchiektasen. In: Kroegel C, Costabel U, Hrsg. Klinische Pneumologie. 1. Auflage. Stuttgart: Thieme; 2013. DOI: 10.1055/b-002-57146)
Allgemeinmaßnahmen
- Physiotherapie: Sekretmobilisation, Lagerungsdrainage (entsprechend der Lokalisation) sowie Klopfmassage
- Wichtig: intensives Üben während des stationären Aufenthalts und eine konsequente häusliche Durchführung zusammen mit einer Hilfsperson
- Ausdauertraining und Muskelaufbau
- Bronchodilatatoren:
- Sekretmobilisation: Physiotherapie, Sekretmobilisations-Geräte (Flutter etc.)
- Mukolyse durch Inhalation von Kochsalzlösung (0,9–7%) analog zur Therapie der Mukoviszidose, 2–4x/Tag; ggf. Mannitol
- rhDNase zeigte keine Verbesserung und sollte nicht verwendet werden
- Lagerungsdrainage und Vibrationsmassage (je nach Lokalisation
- der Bronchiektasen in horizontaler Bauchlage oder Kopftieflage
- in Verbindung mit einer Vibrationsmassage (Vibrax)
- PEP-Maske („positive exspiratory pressure“)
- regelmäßige Inhalationen mit physiologischer Kochsalzlösung
- oder bronchialerweiternden Medikamenten mit einem
- Düsenvernebler
- autogene Drainage („Huffing“)
- Lippenbremse
- Sekretmobilisierung mittels RC-Cornet und VRP1-Flutter
- Impfung: obligat gegen Influenza und Pneumokokken
Pharmakotherapie
Antibiotika
- gezielte Therapie nach Antibiogramm aus der Sputumkultur ist notwendig und auch meist möglich
- generell hohe Dosierung und verlängerte Therapiedauer (2–4 Wochen)
- Eradikation von Pseudomonas ist oft sinnvoll, ansonsten suppressive inhalative Therapie
- NTM: spezifische Therapie nach der Spezies
- Substanzen mit guter Anaerobierwirkung werden bevorzugt
- bei Candidanachweis in der Bronchusbiopsie Fluconazol 0,2–0,4g/24h i.v. oder p.o.
- bei Aspergillom- oder Aspergillusnachweis im Sputum: gezielte Therapie
- ggf. Gabe inhalativer Antibiotika nach Antibiogramm (Tobramycin, Gentamycin, Aztreonam), keine klare Datenlage
- ggf. Makrolid-Antibiotika zur Entzündungsmodulation, analog zu CF
- Beim Nachweis einer neuen Besiedelung mit P. aeruginosa sollte eine Eradikationstherapie angeboten werden (nach Antibiogramm, z.B. β-Laktam + Aminoglykosid, Fluoroquinolon), ggf. gefolgt von einer inhalativen Suppressionstherapie (Colistin, Tobramycin, Gentamycin)
Akute Exazerbation
- wird je nach bakterieller Besiedelung behandelt
- Therapiedauer sollte 14 Tage betragen
- bei akutem, septischem Bild wird eine kalkulierte Antibiose initiiert, bis ein Antibiogramm vorliegt
- bei >3 Exazerbationen pro Jahr kann eine Antibiotika-Langzeittherapie, z.B. mit inhalativen Antibiotika (Pseudomonas) oder systemischen Makroliden (non-Pseudomonas) eingesetzt werden
Antientzündliche Therapie
- keine klare Datenlage in non-CF-Bronchiektasen
- langwirkende Bronchodilatoren (LABA, LAMA) bei Obstruktion in der Lungenfunktion
- inhalative Steroide: unklare Datenlage, angesichts der immunsuppressiven Wirkung, eher zurückhaltend
Operative Therapie
- operative Intervention (funktionelle Operabilitätskriterien wie in der Karzinomchirurgie, kurativ:):
- Indikationen: Befall von mind. 2 Segmenten, höchstens aber eines Lungenflügels bei schwerer Symptomatik trotz adäquater konservativer Therapie über eine Dauer von mind. 6–12 Monaten
- Kontraindikationen: beidseitige Bronchiektasen, symptomlose Erkrankung, schweres begleitendes Lungenemphysem oder chronische Bronchitis, Ateminsuffizienz, Immundefekte, ziliäre Dyskinesie, zystische Fibrose
- Palliativindikationen: massive Hämoptoe, nicht beherrschbare Pneumonien, Aspergillom
- Lungentransplantation: Indikationen: fortgeschrittene Erkrankung mit respiratorischer Insuffizienz, pulmonaler Hypertonie und Cor pulmonale; bei bakterieller Besiedelung bilaterale Transplantation.
- interventionelle Radiologie zur Blutstillung bei starken Hämoptysen
Verlauf und Prognose
- Bronchiektasen bilden sich in der Regel nicht zurück und die Erkrankung ist nicht heilbar.
- unbehandelt schreitet die Erkrankung fort
- lokal kommt es über die chronische Entzündung der Atemwege zu einer Hyperplasie und Hypertrophie der mukusproduzierenden Drüsenzellen und zu einer squamösen Metaplasie
- im Verlaufe führen Bronchiektasen zu einer allmählichen Zerstörung des peribronchiektatischen Lungenparenchyms mit respiratorischer Insuffizienz, pulmonaler Hypertonie und Cor pulmonale
- Die Überlebenszeit hängt von der Ausdehnung der betroffenen Lungenbereiche ab.
- Aufgrund verbesserter Therapiemöglichkeiten (Antibiotika, Physiotherapie) ist die Prognose heute deutlich besser mit in der Regel chronisch persistierendem Verlauf.
- Häufige Todesursachen: Ateminsuffizienz, Sepsis, nicht ausreichend behandelbare Infektion (Pseudomonas species, Pilzpneumonie), Blutsturz, Amyloidose, Hirnabszess.
Prävention
- Bei allen symptomatischen Patienten ist eine Pneumokokken-Vakzination und zusätzlich jährlich in den Herbstmonaten eine Grippeschutzimpfung sinnvoll.
Besonderheiten bei Schwangeren
- sorgfältige Auswahl der medikamentösen Therapie hinsichtlich fetaler Toxizität
- Minimierung der strahlengebundenen Diagnostik in der Schwangerschaft
Literatur
Literatur zur weiteren Vertiefung
-
[1] Polverino E, Goeminne PC, McDonnell MJ et al. European Respiratory Society guidelines for the management of adult bronchiectasis. Eur Respir J 2017; 50(3): 1700629. DOI: 10.1183/13993003.00629–2017
Suche in: PubMed Google Scholar -
[2] Hill AT, Sullivan AL, Chalmers JD et al. British Thoracic Society Guideline for bronchiectasis in adults. Thorax 2019;74(Suppl 1):1–69. DOI: 10.1136/thoraxjnl-2018–212463
Suche in: PubMed Google Scholar -
[3] Ledda RE, Balbi M, Milone F et al. Imaging in non-cystic fibrosis bronchiectasis and current limitations. BJR Open 2021; 3(1): 20210026
Suche in: PubMed Google Scholar
Herausgeber*innen, Autor*innen und Aktualisierung
Herausgeber*innen: Claus Kroegel, Ulrich Costabel, Robert Bals, Christian Taube
Autor*innen: Robert Bals